Allergien gegen Bienen- und Wespengift sind die wichtigsten Formen der Insektengiftallergie. Hornissen- und Hummelgiftallergien kommen seltener vor. Allergische Reaktionen gegen Insektengifte manifestieren sich meist als gesteigerte Reaktionen im Stichbereich, bei bis zu 3,5 % der Bevölkerung treten anaphylaktische Reaktionen auf [1].
Neben der Anamnese werden zur Diagnostik sowohl Pricktests als auch die IgE-Blutuntersuchung auf Bienengift (i1) und Wespengift (i3) empfohlen, da in etwa 10 % der Fälle eines negativen Hauttestes positive IgE-Ergebnisse vorkommen [2]. Um eine maximale Sensitivität zu gewährleisten, sollte die erste Untersuchung 1-4 Wochen nach dem klinischen Ereignis durchgeführt werden. Bei einem negativen Ergebnis trotz eindeutigem Verdacht ist eine Wiederholung 4-6 Wochen später empfehlenswert [3,4].
Durch die komplexe Struktur und durch homologe Peptidsequenzen in Bienen- und Wespengiftallergenen kommen bei der konventionellen Extrakt basierten IgE-Diagnostik nicht selten falsch positive Ergebnisse vor. Für die Patientenaufklärung und noch mehr für die Planung einer Hyposensibilisierung ist es aber wichtig zu wissen, ob eine Bienen- oder Wespengiftallergie oder tatsächlich eine Doppelsensibilisierung vorliegt.
Bei doppelt positiven Ergebnissen kann man nachfolgend auf die Allergenkomponenten der Hymenopterengifte testen. Durch die Molekulare Allergiediagnostik ist es heute möglich, die spezifi schen IgEs gegen die jeweiligen Allergenkomponenten einzeln nachzuweisen. Hier stehen Ihnen für Bienengift die 5 wichtigsten Komponenten Api m1, Api m2, Api m3, Api m5 und Api m10 zur Verfügung. Für Wespengift sind die Komponenten Ves v1 und Ves v5 verfügbar (Tabelle 1). Wichtigster Vorteil ist, dass diese gentechnisch (rekombinant) hergestellten Allergenkomponenten keine kreuzreagierenden Kohlenhydratseitenketten (CCD-Epitope) enthalten und somit eine bessere Abgrenzung zwischen echter Doppelsensibilisierung und Kreuzsensibilisierung möglich ist (Abb. 1).
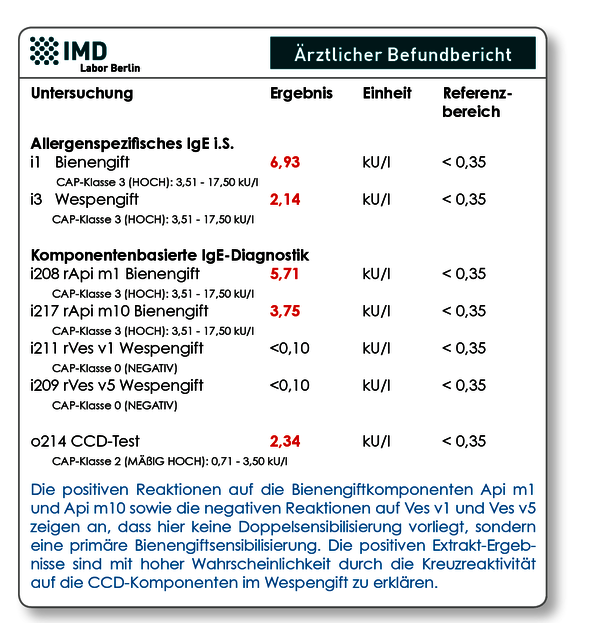
Abb.1 Allergiebefund eines 13-jährigen Jungen nach anaphylaktischer Reaktion nach einem Insektenstich. Die komponentenbasierte Nachfolgediagnostik auf die spezifischen Giftallergene zeigte, dass der Patient ausschließlich gegen Bienengift allergisiert ist.
| Allergen | Funktion | Klinische Bedeutung | Kreuzreaktivität |
|---|---|---|---|
| Bienengift (i1) | |||
| rApi m1 (i208) | Phospholipase A2* | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl | mit Phospholipase A2 der Hummel möglich |
| rApi m2 (i214) | Hyaluronidase* | Minorallergen | mit Hyaluronidase der Wespe möglich |
| rApi m3 (i215) | Saure Phosphatase* | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl (Api m3 kann in therapeutischen Extrakten unterrepräsentiert sein) | |
| rApi m5 (i216) | Peptidylpeptidase IV* | Majorallergen
| mit Peptidylpeptidase IV der Wespe möglich |
| rApi m10 (i217) | Icarapin* | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl (Api m10 kann in therapeutischen Extrakten unterrepräsentiert sein) | |
| Wespengift (i3) | |||
| rVes v1 (i211) | Phospholipase A1
| Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl
| mit Phospholipase A1 verschiedener Wespen und Hornissen möglich |
| rVes v5 (i209) | Antigen 5
| Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl
| mit Antigen 5 verschiedener Wespen und Hornissen möglich |
| Feldwespengift (i77) | |||
| rPol v5 (i210) | Antigen 5 | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl | mit Antigen 5 verschiedener Wespen und Hornissen möglich |
*Native Protein enthalten CCD-Komponenten
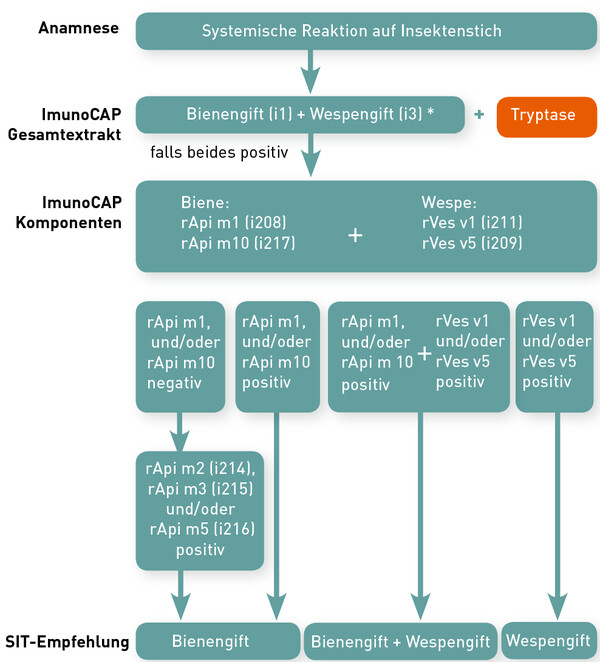
* Wenn beide Extrakte negativ sind sollte auch an den BAT und/oder andere Insekten gedacht werden (z. B. Feldwespe (i77))
Ja, denn weder der EBM noch die GOÄ unterscheiden zwischen der konventionellen und der molekularen IgE-Diagnostik. Die Testung auf die Komponeneten kostet nicht mehr als Gesamtextraktanalysen auf i1 und i3.
Bei klinischem Verdacht auf Bienen- und/oder Wespengiftallergie aber negativem oder fraglich positivem spezifischen IgE auf i1 und i3 empfiehlt sich der Basophilenaktivierungstest (BAT) als zelluläres Testverfahren. Dieser kann in Einzelfällen deutlich positive Ergebnisse zeigen, sogar bei negativem spezifischen IgE. Ursache ist, dass die spezifi - schen IgE-Antikörper bei einigen Patienten nicht frei im Serum vorkommen (und nur diese werden im IgE-Test erfasst) sondern an Mastzellen und basophile Granulozyten gebunden sind. Ca 2 % der Patienten haben diese bindungsfreudigen (hochaffi nen) IgE-Antikörper. Typisch ist bei diesen Patienten ein oft auffällig niedriges Gesamt-IgE. Der Basophilenaktivierungstest (BAT) ist ein Testverfahren, bei dem aus Patientenblut angereicherte basophile Granulozyten des Patienten in vitro mit den Allergenen stimuliert werden. Im Falle einer Sensibilisierung sezernieren diese Zellen Histamin und Leukotriene. Im BAT-Test werden die Leukotriene C4, D4 und E4 erfasst. Durch Vergleich der unstimulierten (basalen) Leukotrienproduktion mit einer allergenstimulierten Probe, kann eine individuelle Sensibilisierung des Patienten mit hoher Sensitivität nachgewiesen werden. (5)

Abb. 2 Der IgE-Nachweis zeigte (grenzwertige) Befunde. Erst im nachfolgend durchgeführten BAT-Test konnte eindeutig die Diagnose einer Bienengiftallergie gestellt werden.
Zur Risikoabschätzung bei Bienen- und Wespengiftallergikern, insbesondere auch vor einer Spezifischen Immuntherapie (SIT) mit Insektengift, sollte die Bestimmung der Tryptase im Serum erfolgen. Bei erhöhter Tryptase besteht ein signifikant erhöhtes Risiko eine sehr schwere Stichreaktion bis zur Anaphylaxie zu erleiden.
Spezifisches IgE, Tryptase: 2 ml Vollblut
BAT: 2 ml EDTA- oder Heparinblut
• Spezifisches IgE gegen Gesamtextrakte der Biene (i1) und der Wespe (i3)
• Spezifisches IgE gegen die Bienengiftkomponenten rApi m1 (i208), rApi m2 (i214), rApi m3 (i215), rApi m5 (i216) und rApi m10 (i217) sowie gegen die Wespengiftkomponenten rVes v1 (i211) und rVes v5 (i209)
• Tryptase
• Basophilenaktivierungstest (BAT) auf i1 Biene und i3 Wespe
Alle genannten Analysen werden sowohl von der gesetzlichen wie auch der privaten Krankenkasse übernommen.
[1] Schäfer T, Epidemiologie der Insektengiftallergie. Allergo J 2009; 18: [1] 353-8
[2] Bilo BM et al. Diagnosis of Hymenoptera venom allergy. Allergy 2005; 60:1339-1349
[3] Goldberg A et al, Timing of venom skin tests and IgE determinations after insect sting anaphylaxis. JACI 1997; 100:182-4
[4] Matricardi PM et al. EAACI Molecular Allergology User’s Guide. Pediatr. Allergy Immunol. 2016, 27 Suppl 23: 1-250
[5] Wedi B, Kapp A. Cellular in-vitro assays. Applicability in daily routine Hautarzt. 2010;61:954-60.